欢迎光临吉康旅!
3月23日,复星医药旗下复宏复宏汉霖发布2019年年报。国内首个生物类似药发布首年成绩单。
2019年,复宏汉霖营收约9090万元,主要得益于利妥昔单抗(商品名:汉利康)的商业化。全年亏损总额为8.75亿,主要是研发扩张所致。
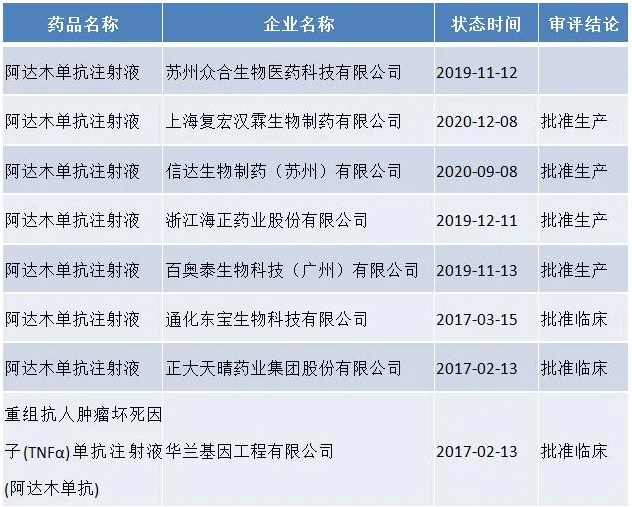
自2019年初首个生物仿制药利妥昔单抗上市以来,目前中国上市的生物仿制药有四种,分别是Bio-Tech的阿达木单抗(格力)和海正生物的阿达木单抗。齐鲁制药的单克隆抗体(安建宁)和贝伐单抗(安卡拉)。
利妥昔单抗生物类似药的研发虽然是“十年一剑”,但在追赶国际速度方面,还远不能与当年的小分子药物相媲美。复宏汉霖联合创始人、总裁兼CEO刘世高在汉利康发布会上表示,“汉利康是全球第三个获批的生物仿制药利妥昔单抗。”
继美欧之后,在PD-1/L1同类药物布局方面,中国市场也成为生物类似药研发管线最多的国家。激烈的竞争是不可避免的。在研发创新、品种选择、卡片投放及后续商业化销售、渠道、产能、价格等方面,国内企业面临的挑战与机遇并存。
与原创研究的竞争
生物仿制药是指在质量、安全性和疗效上与注册参比药相似的治疗性生物制品。大量生物仿制药的可用性将有助于提高生物制剂的可用性和降低价格,让更多的患者使用这些药物。

与仿制小分子化学药不同,生物类似药的开发要复杂得多。由于制造工艺和分子本身的特点,生物大分子药物很难具有与原研药完全相同的结构和功能,只能是相似的,因此被称为生物类似药。
根据刘士高给出的数据,一个生物原药大约需要8到10年、8亿美元才能成功,而一个生物类似药需要经过更多的步骤,大约需要7到8年、1到3亿美元。美元。
欧美早在多年前就开始研发和投资生物类似药,这也满足了各国控制成本的需求,监管机构也给予了积极反馈。跨国药企因专利悬崖和生物类似药发生纠纷的情况并不少见。
2017年2月,韩国首个获准在欧盟上市;2017年6月,山德士也在欧盟获批,2018年11月,又获FDA批准上市。
根据 FDA 药物评价与研究中心(CDER)发布的新药批准报告,2019 年,CDER 批准了十种新的生物类似药。成本。”
同时,原研药企业采取了更为直接的竞争方式。2017年以来,一批热门单克隆抗体药物通过大幅降价进入医保目录。
例如,利妥昔单抗的原研药是罗氏利妥昔单抗,这是罗氏基因泰克最初开发并获得FDA批准用于治疗癌症的第一个单克隆抗体。目前,利妥昔单抗在欧美市场有生物类似药上市。2000年4月21日,罗氏的利妥昔单抗获CFDA批准上市,2017年通过谈判进入医保目录,降价58.45%,此后市场大幅上涨。/50ml/瓶的规格从RMB降到了8298元,/10ml/瓶的小号也降到了2418元。
2019年11月,全国医保谈判落下帷幕,连续七年成为世界“药王”的修美乐(阿达木单抗)也在“挣扎”多年后进入医保。从单价7600多元,修美乐在网上主动降价60%至3160元,直至以1290元/瓶的价格中标国家医保目录。
在这种情况下,部署生物仿制药的公司不得不调整战略,以面对来自原始研究的低价竞争。
“因为整个行业还有很大的提升空间,国内同类药有一个替代原研的过程,还有一部分市场空间可以抢。” 东方高盛执行董事曲荣告诉21世纪经济报道记者,“但在原研药降价高达60-70%的情况下,同类药的价值空间和收益公司可能没有之前预期的那么高,也不符合立项期间的财务模式。”
汉利康在上市后也进一步下调了价格。上市时价格为1648元/10ml:0.1g,比同产品规格的罗氏原研药低30%左右;进一步降价后,全国零售药店价格为1398元/片(/10ml)。
“汉力康的上市开启了中国抗体药物的新时代。根据市场反馈,目前该产品供不应求,受限于产能,公司已经全面扩产。” 一位业内人士告诉记者,“该产品目前正在申请新增适应症,同时也在美国和欧盟申请上市,将成为中国生产的首个面向全球的生物类似药。”销量,未来的市场潜力值得期待。”
与同行竞争
除了与原研的“价格战”,国内生物类似药生产企业还面临着后续与众多同类产品的激烈竞争。
艾昆伟预计,随着生物药专利到期和大量生物类似药上市,2020年全球生物类似药市场规模将达到300亿美元左右。中国生物药和生物类似药市场份额约占1%全球市场,在研药物项目数量居全球首位,且大部分集中在肿瘤和免疫疾病领域。预计到2030年,中国抗体生物类似药销售额将达到42亿美元,占该药总销售额的35%。
在主要的单克隆抗体药物中,涉及利妥昔单抗、曲妥珠单抗、贝伐单抗、阿达木单抗、英夫利昔单抗、依那西普等药物,包括复宏汉霖、复宏汉霖、信达生物、康宁杰瑞、神州细胞、海正药业、齐鲁药业、丽珠药业、正大天晴、阳光国健、双鹿药业、华兰基因等已入驻会场。
上述业内人士表示,“生物药是全球增长最快的药物种类,生物类似药的潜力被广泛看好。目前全球多家企业都在开发生物类似药,市场机会非常明显。” ,但也有不可避免的挑战,它们也是同时并存的。整体来看,国产生物类似药的市场表现与产品质量和疗效、产品研发和销售的先发优势、产品适应症是否相同有关。 “作为原研药,公司产品能否形成组合,与市场开拓能力是一个非常重要的关系。”
以复宏复宏汉霖为例,除汉利康在中国和欧洲的曲妥珠单抗外,它成为第一个被欧盟接受的“中国”生物类似药;以及(阿达木单抗注射液)作为新药获国家食品药品监督管理局批准,药品证书申请被受理并纳入优先审评程序;(贝伐单抗生物类似药)3期临床试验已完成患者入组。
从欧美市场的经验来看,首发生物类似药的先发优势明显。IMS数据显示,欧洲市场首个生物类似药迅速替代该类药物,稳定后所有生物类似药市场占有率均较高(平均为70%)。与原研药相比,竞争少、价格大幅下降是帮助首个上市的生物类似药快速抢占市场的主要原因。
后期进入的生物类似药在抢占市场方面略显薄弱。例如,EMA批准上市的第二个生物类似药(英夫利昔单抗)进入欧洲市场后,与原研和第一个生物类似药(已上市两年多)处于同一领域. 竞争之下,第一年只抢占了7%的市场份额,第二年销量增长,市场份额上升到3.4%,不如当年的市场上市第二年。1/3 的份额。
“现在的大趋势是逐步将单克隆抗体纳入医保名单,让更多患者受益。因此,在市场定位上,复宏汉霖、百奥泰、齐鲁等具有先发优势。药品获批后,龙头企业将逐渐形成渠道和销售团队壁垒,创新药企业现已逐步从研发阶段过渡到商业化阶段。曲荣说,其中很多还处于早期临床阶段。如果前期有四五家公司上市,难免会有价格战。后期建立自己的业务团队的成本很高,挖人的成本也很高。在将来,
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话