肝癌细胞是如何对抗线粒体损伤和ROS增加而产生耐药的呢
发布日期:2021-10-08 浏览次数:556次
中国是乙肝大国,约有8000万患者,即世界上三分之一的乙肝人口在中国。得益于 1990 年代实施的 HBV 疫苗计划,目前中国 5 岁以下儿童的 HBV 感染率仅为 1%,但 HBV 感染率下降到肝病发病率的降低还需要一段时间。癌症。目前,肝细胞癌(HCC)是中国第四大常见恶性肿瘤,也是导致肿瘤死亡的第三大原因。
研究背景:
过去十年,索拉非尼是唯一获批用于治疗晚期肝癌的分子靶向药物。索拉非尼在两项大规模临床试验和索拉非尼泰(AP)三期试验中均能有效改善患者的预后。然而,索拉非尼的益处非常有限。由于在治疗过程中经常出现耐药性,患者的中位生存时间只能延长约3至5个月。
以往的研究发现,耐药机制主要包括ERK、PI3K等与细胞存活相关的通路中蛋白表达异常。同时,自噬、上皮间质转化(-,EMT)、缺氧相关蛋白也与索拉非尼耐药有关。最近的一些研究发现,线粒体也可能是索拉非尼的靶点之一。
考虑到活性氧(ROS)往往在药物疗效反应中起关键作用,线粒体不仅与细胞凋亡密切相关,而且是细胞内ROS的主要来源。所以我们想探讨线粒体在索拉非尼耐药的发生和发展中起什么作用。肝癌细胞如何抵抗线粒体损伤和增加的ROS产生耐药性?

主要过程和发现:
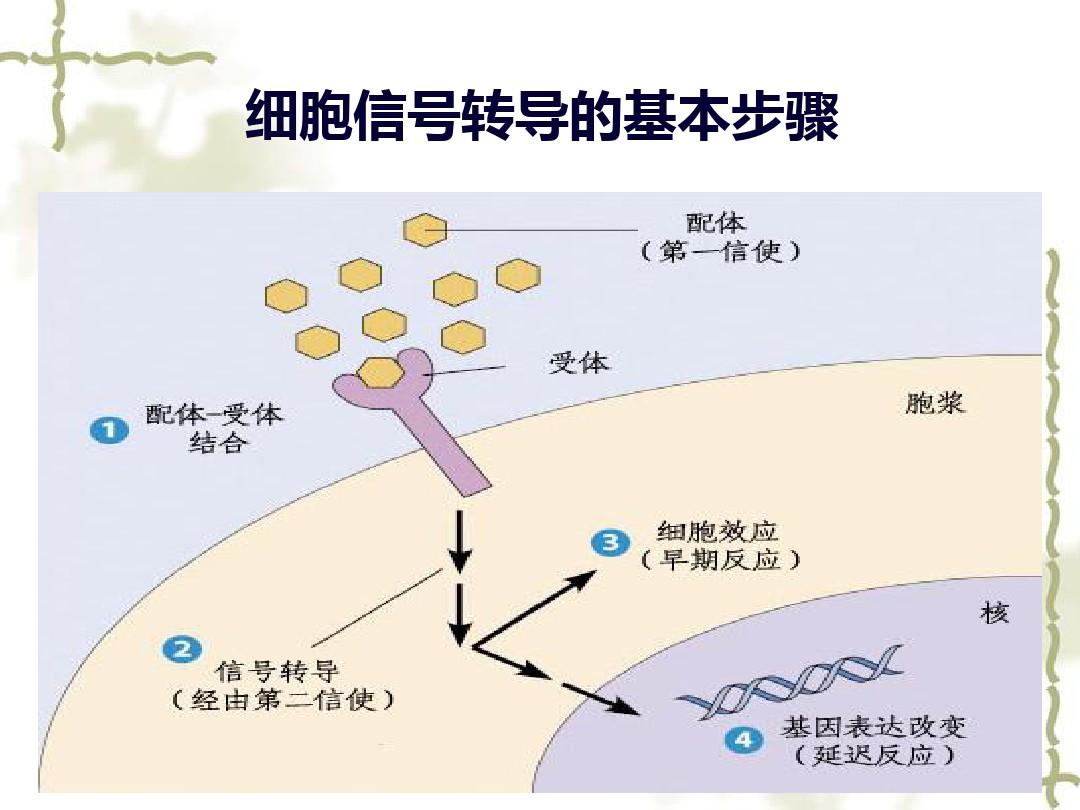
图 1 -RUSH 涉及的索拉非尼耐药机制
首先,通过长期接触缓慢增加的索拉非尼,我们构建了 3 个对索拉非尼具有抗性的细胞系。然后我们在索拉非尼和未处理条件下测试了这些细胞的 ROS 水平。我们发现在野生型 HCC 细胞系中,索拉非尼治疗可以增加细胞内 ROS 水平。然而,在耐药细胞系中,索拉非尼治疗后细胞内 ROS 水平降低。
通过流式细胞术,耐药细胞线粒体跨膜电位的降低小于野生型细胞。透射电子显微镜(TEM)结果还表明,在野生型细胞系中,线粒体更变形,而耐药细胞中的线粒体似乎保持了更完整的形态。考虑到细胞可能通过自噬降解受损的线粒体,细胞内发生的自噬水平也可以反映细胞内线粒体受损的情况。我们测试了药物治疗下耐药细胞和野生型细胞的自噬水平,发现耐药细胞的自噬水平较低,这与耐药细胞线粒体损伤程度低是一致的。
为了进一步研究其背后的机制,我们使用环状RNA芯片检测(),发现并命名为-RUSH(在HCC中)在耐药细胞中显着增加。通过转染技术减少这种情况可以增加细胞内 ROS 水平,降低线粒体跨膜电位,并诱导自噬。ROS抑制剂N-乙酰半胱氨酸(N-,NAC)可以部分挽救还原诱导的细胞凋亡。因此,我们相信索拉非尼耐药细胞的这种增加可以增强细胞对线粒体损伤和 ROS 的耐受性。
为了更好地证明我们的理论,我们进行了质谱来筛选可能的分子。有趣的是,质谱结果的基因 (GO) 分析表明,还原后,线粒体相关蛋白富集。过去的研究表明,线粒体的损伤可能会导致一些错位的线粒体蛋白增加,错位的线粒体蛋白与细胞内 ROS 水平之间可能存在联系。所以这个GO分析的结果也很好地证明了我们的理论。同时,KEGG分析也显示代谢相关通路在减少后富集。
然后通过RNA技术,得到结合蛋白,对结合蛋白再次进行质谱检测。通过比较这两次的质谱结果,我们发现该蛋白质出现在该组中,这表明它可能与其结合。以前的文献报道,蛋白质可以帮助降解错位的线粒体蛋白质。也有文献支持减少ROS对细胞的损伤。同时,最后的质谱结果也表明蛋白质在还原后被还原。所以我们假设 -RUSH 可以稳定蛋白质并发挥其功能。
为了验证这一假设,我们进行了RNA免疫沉淀、后RNA印迹检测和共定位荧光显微镜(图2)。实验结果与我们的假设一致。这些结果证明蛋白质相互结合。
图2 相互结合
然后,我们通过印迹实验比较了耐药细胞和野生型细胞中蛋白质的表达,发现耐药细胞中的蛋白质表达高于野生型细胞。而降低-RUSH可以加速蛋白质的降解(图3).
图3 耐药细胞中-RUSH的减少加速蛋白质降解
转染沉默后,细胞内ROS水平升高,线粒体跨膜电位降低。此外,实验还发现蛋白的过表达可以部分挽救一些因消耗而引起的细胞凋亡(图4).
图4 蛋白过表达可部分挽救耗竭诱导的细胞凋亡
总结与展望:
这项研究还有很多工作要做。首先,蛋白质的过度表达并不能挽救所有减少造成的死亡。因此,我们认为可能有其他机制导致索拉非尼耐药。其次,单个可能无法完全解释我们构建的这些细胞系中索拉非尼耐药的机制。所以还需要进一步研究。但是,我们相信目前的实验结果可以很好地证明蛋白质和-RUSH确实参与了这个过程。因此,它们可能是克服索拉非尼耐药性的潜在目标。

