欢迎光临吉康旅!
郑重声明:即日起,如有关于股票和大盘的问题,可以直接在文章下方的留言区留言,我一定会一一解答。现在,老克有的是时间!老柯的留言区不再是空白,这是我继续输出优质文章的压力和动力!说实话,我也想当大V,看了之后很喜欢,家里也很有钱。记得注意,做就行!
周二,我们整理了四家上市已久的创新药企业——恒瑞医药、汉森药业、中国生物制药和贝达药业。制药公司。
05
百济神州
百济神州成立于 2011 年,至今仅十年。公司用十年时间实现了自主研发的两款创新药和的上市,其中是美国第一个获批的药物。获批的国产创新抗肿瘤靶向药也是全球第三种BTK抑制剂,也是第一种国产BTK抑制剂,而替雷利珠单抗是第四种国内上市的PD-1抑制剂,将用于后续适应症。发展进度非常快。
2017年,百济神州将替雷利珠单抗的海外商业化权授权给跨国制药巨头之一的新基(),但自从新基()后来被百时美施贵宝(BMS)收购后,百济神州(BMS)已经拥有了纳武单抗(全球第二大上市PD-1单克隆抗体)这个重磅药,所以新基与百济神州在PD-1上的合作终止了,但百济神州与新基在中国负责销售新基三药的合作仍然有效(其中白蛋白-紫杉醇因质量问题被禁用) )。
2019年11月,获美国FDA批准用于成人套细胞淋巴瘤患者的二线治疗。零突破,预计大适应症获批后量产将加速。
2019年12月末,替雷利珠单抗获批上市为国内第6个PD-1单克隆抗体和第4个国内上市的PD-1 mAb。同时在2020年医保谈判中成功纳入国家医保目录。目前,替雷利珠单抗单抗已获批三个适应症:复发或难治性霍奇金淋巴瘤、二线尿路上皮癌、联合化疗鳞状非小细胞肺癌一线治疗,非鳞状非小细胞肺癌一线联合化疗。肺癌、肝细胞癌二线和非小细胞肺癌二三线治疗等三个适应症,虽然公司上市进度比较晚,
2020年5月,赞布替尼获准在中国上市,成为公司第二个创新药,也是第一个在中国上市的国产BTK抑制剂。约15万元,类似进口药依鲁替尼的年药费约25万元。兼具疗效和价格优势。
2021年,公司parp抑制剂有望获批上市,成为国内生产的第二个、国内上市的第四个parp抑制剂。国产parp抑制剂将是阿斯利康、再鼎医药、恒瑞医药、百济神州。四家公司同台竞技,分别是跨国医药巨头、国内传统医药巨头、国内创新药龙头、国内in-龙头的较量,颇具看点。
总结:
百济神州是国内创新药企业中国际化程度最高的公司。2021年1月,公司以总首付22亿美元+里程碑费用向诺华授权替雷利珠单抗,创下国产新药上市新纪录。该记录,包括6.5亿美元的首付,可以进一步丰富公司的现金流,保障公司研发支出所需的现金流。
公司拥有丰富的自主研发管线,成立仅十年,即将实现第三个自主研发创新药产品的商业化。同时,公司与包括、、等在内的多家跨国药企达成深度合作,在In/Out、In拥有强大的研发能力,开始验证自身的创新药商业化能力,并很有可能成长为国内的创新药公司。
截至2020年底,公司现金余额为46.6亿美元,叠加1月份收到诺华6.5亿美元的首付,以及账户现金超过53亿美元。现金储备足以在未来几年保护公司。研发投入。
06
信达生物
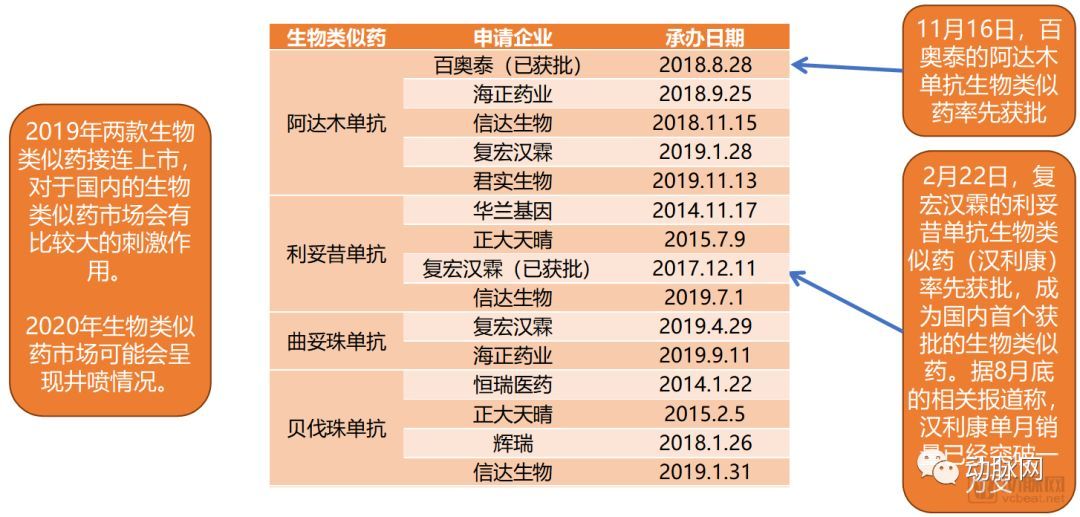
信达生物成立于2011年,比百济神州晚了三个月。其创始人于德超是国内生物制药领域的领军人物之一。公司还建立了丰富的自主研发创新药物管线。药物和三种生物类似药获批上市。该公司和复宏汉霖都是以生物仿制药起家的。两家公司在2015年前后“分道扬镳”,信达生物将研发重心转移到以PD-1单克隆抗体为主导的创新生物药的研发和商业化。复宏汉霖拥有丰富的创新生物药管线,长期以来一直专注于生物类似药的研发。迄今为止,两家公司的市值相差5倍。
2018年12月,信迪利单抗获批用于转移性霍奇金淋巴瘤的三线治疗,成为继君实生物之后国内第二个获批的PD-1单抗。1月开始销售,一季度销售额突破3亿元,2020年销售额达到22亿元。
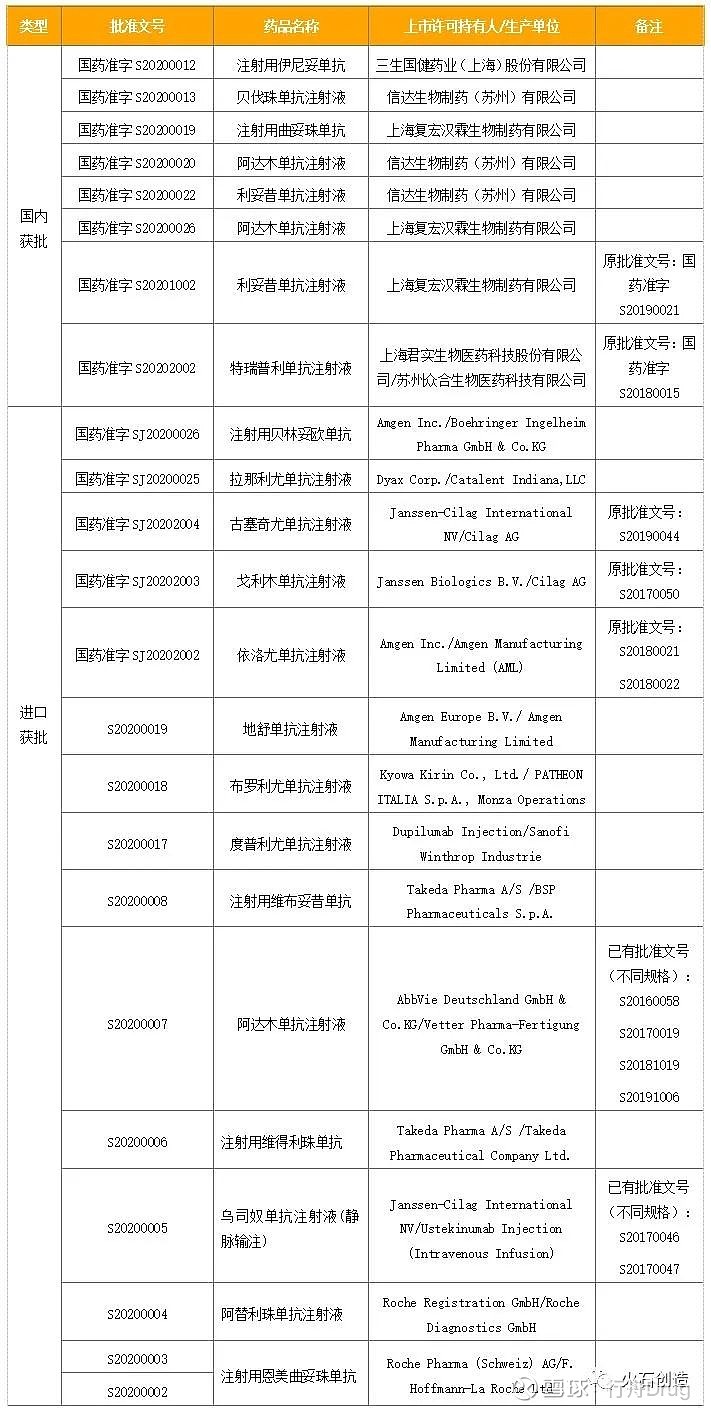
2020年6月公司贝伐单抗生物类似药获批上市,2020年9月阿达木单抗生物类似药获批上市,2020年10月利妥昔单抗生物类似药获批上市。信迪利单抗的生物类似药上市速度已经超过复宏汉霖,由此可见不同公司在研发效率上的差距。
2021年2月,公司用于非鳞状非小细胞肺癌一线治疗的联合化疗获批上市,在国内厂商中仅次于恒瑞医药,比恒瑞获批时间晚约8个月;2020年8月 一线治疗鳞状非小细胞肺癌的联合化疗已提交上市申请,预计今年第二季度获批上市,仅次于百济神州,预计比百济神州晚半年左右。
2021年1月,公司提交了信迪利单抗联合贝伐单抗一线治疗肝细胞癌的上市申请,为国内首家生产商。公司治疗方案改写了一线肝癌的ESMO指南,成功推出后有望成为全球领先者。首个PD-1+贝伐单抗一线治疗肝癌(罗氏是PD-L1+贝伐单抗)将惠及中国庞大的肝癌患者。
总结:
信达信的三大核心适应症是目前一线非鳞状非小细胞肺癌、一线鳞状非小细胞肺癌和一线肝癌的国内前两名甚至国内第一。主要适应症将直接决定PD-1的销售空间和市场份额;2019年,信迪利单抗上市后成为国内首个纳入国家医保目录的PD-1单克隆抗体,并实现2000多家医院入院。
2020年礼来将以10.25亿美元+里程碑费用的方式获得信迪利单抗的海外商业化权。礼来公司计划2021年向FDA提交信迪利单抗上市申请(可根据中国临床数据上报),礼来此前放弃了信迪利单抗的海外权益,现以1000万美元回购10亿美元的价格,可能是因为看到了优秀的临床数据,而且公司本身也需要肿瘤免疫抑制剂来丰富产品管线。此外,信达生物与罗氏合作获得罗氏技术,开发双特异性抗体和CAR-T疗法。这也是罗氏首次开放其双抗体技术平台。罗氏也有2个。
信达生物在过去几年陆续验证了其研发能力、临床效率和商业化能力,研发管线更加充实和丰富,朝着这条道路迈出了坚实的一步。在国际化方面,公司的业绩仅次于百济神州。公司在深度绑定礼来和罗氏这两家顶级跨国药企的同时,实现了核心产品的走出去。商业授权带来的收益可以达到甚至超过PD。-1 在国内市场的销售可以给信达带来的好处。
07
君实生物
君实生物成立于2012年,比百济神州和信达生物晚了近2年,但君实生物从2013年就在美国设立了研发中心,也是一家国际化意识很强的公司。虽然君实生物成立的时间稍晚,但在PD-1单克隆抗体的研发上,已经成为国内第一个获批上市的产品。
2018年12月17日,特瑞普利单抗获批上市,成为国内首个获批的PD-1抑制剂,比信迪单抗获批提前10天。2021年2月19日,特瑞普利单抗的第二个适应症在鼻咽癌二线治疗中获批上市,鼻咽癌一线治疗的上市申请也于2月11日获受理。
2020年5月,公司以1000万美元的预付款+2.45亿美元里程碑付款+两位数的销售份额将新冠中和抗体授权给礼来公司,并于2021年2月获得美国FDA基金授权LY-联合治疗新冠患者,预计中和抗体项目将为君实生物带来总计3-50亿的现金流。
2020年9月,特瑞普利单抗成为国内首个获得美国FDA突破性疗法认证的PD-1单抗。2021年3月3日,公司向美国FDA提交了特瑞普利单抗滚动上市申请,再次在美国本土创新药滚动上市申请中取得突破,也是国内首个PD-美国报道了1个单克隆抗体。
总结:
君实生物的产品开发有一些差异化竞争的思路,包括PD-1不及恒瑞、百济等大公司,在小适应症和辅助治疗方面发力。公司BTLA单克隆抗体有望在公司BTLA单克隆抗体双重申报中成为全球最佳in/in新药。2020年PD-1的高销量,尤其是下半年的销量,基本验证了公司的快速销售能力。后续,特瑞普利单抗与阿斯利康在非核心市场(县域市场)的商业化,将有助于两家公司优势互补。
我们认为,君实生物虽然在各方面与百济、信达相比略有差距,但在自研、BD、销售等方面已经验证了自身实力,确定性有了很大提升,在方面也有潜力。未来。
08
康方生物
康方生物成立于2012年,成立时间不长,但充分展示了其强大的创新和研发能力。早在2015年,公司就向默克公司授权(CTLA-4单克隆抗体),而默克公司近日在中国申报。这个产品的临床试验有点像“出口转内销”。
2017年底,公司在澳大利亚启动I期临床试验(PD-1单克隆抗体)。2020年5月,提交首个霍奇金淋巴瘤适应症上市申请。(占比50%)PD-1 mAb的研发和商业化将依赖于中国生物制药庞大的销售团队,但即便如此,面对国内四款竞品已被纳入国家医保目录的事实,销售压力还是客观存在的。
2021年,预计公司PD-1单克隆抗体将在年中获批。同时,三线鼻咽癌和一线非小细胞肺癌适应症也有望在今年申请上市。该公司正在迎头赶上肺癌和肝癌的大适应症。中间。
2021年,公司有望提交宫颈癌二、三线治疗的NDA申请(PD-1/CTLA-4双抗体),有望实现;公司还在ASCO会议上公布了(PD-1/CTLA-4双抗体)联合化疗一线治疗晚期胃癌/胃食管结合部癌的Ib/II期临床数据,显示出良好的安全性和有效性,目前在III期临床试验;同时,公司也在开展联合化疗,挑战一线非小细胞肺癌的适应症。
总结:
与单克隆抗体和小分子药物相比,该技术平台未来在双抗体、ADC、细胞治疗、基因治疗、小分子核酸药物等领域将更加重要。而拥有良好技术平台的小分子、双抗体/ADC公司可以获得平台溢价。
2021年,与中国生物制药合作的PD-1单克隆抗体即将进入商业化阶段,与其相关的多项重要适应症已进入临床后期或即将申报上市。展望未来,公司将自建团队商业化,同时也获得了美国FDA用于宫颈癌治疗的快速通道批准,并获得了良好的ORR数据。.
8家国内创新药核心企业,这里简单介绍一下,创新药投资难度较大,专业要求较高。虽然有创新药ETF(),但这只ETF的持股量还不足以覆盖很多优秀的公司(因为很多都是港股上市的),虽然医药行业整体增速不高,但占比医药行业创新药产业规模将快速增长,未来无论国际化程度如何,都是万亿级增量市场。会创造很多十倍甚至一百倍的牛股,还是值得有兴趣的投资者多花点时间精力去看看。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话