欢迎光临吉康旅!
国家药监局药品审评中心抗肿瘤药物发展趋势分析发布日期:专栏:化学药物综合评价标题:抗肿瘤药物研发趋势分析作者: Chen , Hong, Gao , and Yang 科室:临床医学 1 1 引言 癌症是严重威胁公众健康的恶性疾病。大多数肿瘤预后差,生存期短,缺乏治愈方法,临床需求未得到满足。近年来,它们逐渐成为导致死亡的主要原因。迫切需要发现新的治疗方法。近10年来,随着基础医学研究的进步和临床治疗模式的转变,一些新的抗肿瘤药物靶点的发现,使抗肿瘤药物的研发发生了翻天覆地的变化,从传统的细胞毒性类药物转向非细胞毒性靶向药物的开发。本文对2005年1月1日至2011年12月31日国家食品药品监督管理局(SFDA)受理的抗肿瘤新药申请情况进行梳理和综述,总结分析了我国抗肿瘤新药的研发情况。过去十年。主要趋势和未来预测有望为抗肿瘤药物研发相关人员提供近十年来分子靶向肿瘤药物上市所带来的巨大成功刺激。尽管全球医药行业整体销售利润增速有所放缓,
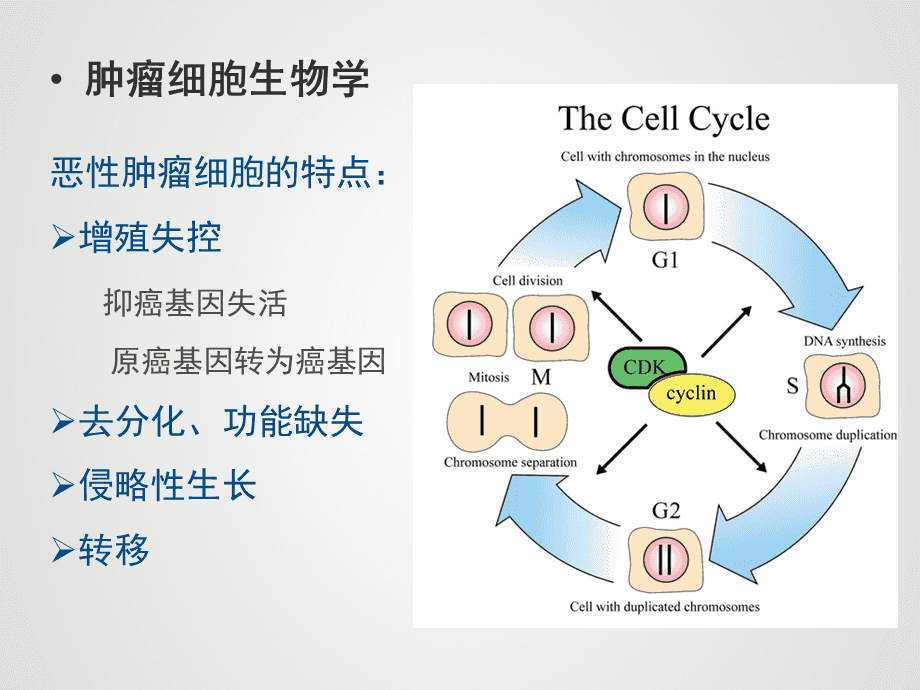
据美国市场统计,2000年销量排名前十的药品中,只有两种年利润超过10亿美元。到2010年,前十大药物已超过10亿美元,其中一半是靶向药物。其中,单克隆抗体处于领先地位,如贝伐单抗、利妥昔单抗、曲妥珠单抗、西妥昔单抗,伊马替尼是靶向性最强的小分子靶向药物[3]。这些药物价格昂贵,需要长期连续用药和联合用药,大大增加了每位患者的治疗成本。国内销售市场也是如此,2011年利妥昔单抗、曲妥珠单抗、吉非替尼、厄洛替尼的销量甚至比往年增长了5-10倍。这意味着市场上的每一种新药都是“重磅炸弹”。如此高的利润势必会吸引更多想要分一杯羹的公司。2.3 分子靶向抗肿瘤药物的研发成为主流。传统的细胞毒性药物非特异性地阻断细胞分裂并导致细胞死亡。在杀死肿瘤细胞的同时,也会破坏正常的人体细胞,容易引起治疗相关毒性,可能会缩短患者的寿命。因此,研发能够以新的作用机制选择性杀伤或抑制肿瘤细胞的抗肿瘤药物成为研究人员的目标。分子生物学和细胞生物学的快速发展揭示了肿瘤细胞生长、增殖和调控的许多分子机制。在此基础上,又发现了许多新的抗肿瘤药物靶点。@2.3 开发分子靶向抗肿瘤药物已成为主流。传统的细胞毒性药物非特异性地阻断细胞分裂并导致细胞死亡。在杀死肿瘤细胞的同时,也会破坏正常的人体细胞,容易引起治疗相关毒性,可能会缩短患者的寿命。因此,研发能够以新的作用机制选择性杀伤或抑制肿瘤细胞的抗肿瘤药物成为研究人员的目标。分子生物学和细胞生物学的快速发展揭示了肿瘤细胞生长、增殖和调控的许多分子机制。在此基础上,又发现了许多新的抗肿瘤药物靶点。@2.3 开发分子靶向抗肿瘤药物已成为主流。传统的细胞毒性药物非特异性地阻断细胞分裂并导致细胞死亡。在杀死肿瘤细胞的同时,也会破坏正常的人体细胞,容易引起治疗相关毒性,可能会缩短患者的寿命。因此,研发能够以新的作用机制选择性杀伤或抑制肿瘤细胞的抗肿瘤药物成为研究人员的目标。分子生物学和细胞生物学的快速发展揭示了肿瘤细胞生长、增殖和调控的许多分子机制。在此基础上,又发现了许多新的抗肿瘤药物靶点。传统的细胞毒性药物非特异性地阻断细胞分裂并导致细胞死亡。在杀死肿瘤细胞的同时,也会破坏正常的人体细胞,容易引起治疗相关毒性,可能会缩短患者的寿命。因此,研发能够以新的作用机制选择性杀伤或抑制肿瘤细胞的抗肿瘤药物成为研究人员的目标。分子生物学和细胞生物学的快速发展揭示了肿瘤细胞生长、增殖和调控的许多分子机制。在此基础上,又发现了许多新的抗肿瘤药物靶点。传统的细胞毒性药物非特异性地阻断细胞分裂并导致细胞死亡。在杀死肿瘤细胞的同时,也会破坏正常的人体细胞,容易引起治疗相关毒性,可能会缩短患者的寿命。因此,研发能够以新的作用机制选择性杀伤或抑制肿瘤细胞的抗肿瘤药物成为研究人员的目标。分子生物学和细胞生物学的快速发展揭示了肿瘤细胞生长、增殖和调控的许多分子机制。在此基础上,又发现了许多新的抗肿瘤药物靶点。研发能够以新的作用机制选择性杀伤或抑制肿瘤细胞的抗肿瘤药物已成为研究人员的目标。分子生物学和细胞生物学的快速发展揭示了肿瘤细胞生长、增殖和调控的许多分子机制。在此基础上,又发现了许多新的抗肿瘤药物靶点。研发能够以新的作用机制选择性杀伤或抑制肿瘤细胞的抗肿瘤药物已成为研究人员的目标。分子生物学和细胞生物学的快速发展揭示了肿瘤细胞生长、增殖和调控的许多分子机制。在此基础上,又发现了许多新的抗肿瘤药物靶点。
这些靶点相对特异性,可以阻断肿瘤生长或降低对正常细胞的影响,并且毒性相对较低。因此,抗肿瘤药物的发展已经从细胞毒性药物和广谱细胞周期抑制剂转向更具特异性的细胞信号转导抑制剂,包括大分子单克隆抗体和小分子化合物。其中,小分子酪氨酸激酶抑制剂(TKI)是最热门的抗肿瘤药物。2005年之前,SFDA受理的TKI新药不到5个,但到2011年底,申请总数已超过50个。 下表1、 表2总结了小分子丁酸激酶抑制剂受理情况截至2011年12月31日在中国审定,包括外国公司和国内公司的产品。可以看出,几乎所有的大型跨国制药公司都参与了进来,而且每家公司都有不止一种产品。酪氨酸激酶是细胞信号转导通路中的一种关键酶。根据结构可分为受体型酪氨酸激酶。国家食品药品监督管理局药品审评中心。抗肿瘤药物发展趋势分析(,RTK)和非受体酪氨酸激酶(,nRTK)两种。RTK 通常是一种具有内源性 RTK 活性的细胞表面受体。它具有胞外配体结合域、跨膜域和胞内激酶域。根据其胞外配体结合域的结构,可进一步分为四个亚类:< @一、 表皮生长因子受体(grow th, EGFR)家族是细胞外信号传递到细胞的重要枢纽。它参与信号转导、细胞增殖,在分化和各种调控机制中发挥重要作用;其主要成员有EGFR(HER1/)、HER2()、HER3()和HER4();第一个二、胰岛素受体(,INSR)家族,包括胰岛素受体,胰岛素样生长因子受体(IGF1-R)等,这些受体的高表达在血细胞肿瘤中很常见;第一个三、血小板衍生生长因子受体(,)家族,细胞增殖和它在分化和各种调节机制中起重要作用;其主要成员有EGFR(HER1/)、HER2()、HER3()和HER4();第一个二、胰岛素受体(,INSR)家族,包括胰岛素受体,胰岛素样生长因子受体(IGF1-R)等,这些受体的高表达在血细胞肿瘤中很常见;第一个三、血小板衍生生长因子受体(,)家族,细胞增殖和它在分化和各种调节机制中起重要作用;其主要成员有EGFR(HER1/)、HER2()、HER3()和HER4();第一个二、胰岛素受体(,INSR)家族,包括胰岛素受体,胰岛素样生长因子受体(IGF1-R)等,这些受体的高表达在血细胞肿瘤中很常见;第一个三、血小板衍生生长因子受体(,)家族,
目前成功的产品也主要针对这些目标。肝细胞生长因子(HGF)及其受体c-Met蛋白也是目前研究最多的一种,很有可能成为下一个成功的靶点。因为肿瘤的生长和存活不仅取决于受体或信号通路,它作用于多个靶点。单一药物可产生多种药理活性,实现对信号通路中多个环节的抑制。因此,作用于多个靶点的小分子酪氨酸激酶抑制剂似乎是目前的主要发展方向,约占3/4。并且极有可能成为下一个成功的目标。因为肿瘤的生长和存活不仅取决于受体或信号通路,它作用于多个靶点。单一药物可产生多种药理活性,实现对信号通路中多个环节的抑制。因此,作用于多个靶点的小分子酪氨酸激酶抑制剂似乎是目前的主要发展方向,约占3/4。并且极有可能成为下一个成功的目标。因为肿瘤的生长和存活不仅取决于受体或信号通路,它作用于多个靶点。单一药物可产生多种药理活性,实现对信号通路中多个环节的抑制。因此,作用于多个靶点的小分子酪氨酸激酶抑制剂似乎是目前的主要发展方向,约占3/4。
维持)/ALL(Ph+)CML(Ph+)(二线)国家药监局药品审评中心抗肿瘤药物发展趋势分析 PF-HKI-272 SKI---9766马来酸西地尼布 TKI-OSI--869 注:NDA:申请生产EGFR、-3/ /C-kit -2、EGFR C-Met/HGFR/、FGFR -3、/HER2/、HER2 Bcr-Ab1、Src ? 2/3,FGFR/C?-1-3 VEGF/FLT-3/KDR C-kit/ -3/-3/C-Kit c-/HER2 /FGFR/-, -.3/NDA 2009.10/.11/Ⅲ 201期1.4/NDA 2011.
同一个靶点药物可能有多个在研药物,比如EGFR,已经有3个上市,还有3个处于早期临床阶段的药物,不包括针对EGFR的单克隆抗体。还有6个靶向EGFR/HER2双靶点。VEGF 已经有 10 多个靶点。同时,同一适应症也有多个药物开发,其中大部分集中在发病率高、市场潜力大的肿瘤类型,被认为是最多的。另一方面,高发肿瘤物种的激烈竞争导致更多的公司转向或分散到其他罕见的肿瘤物种,因此,即使是小的适应症也变得拥挤。例如,肾癌(RCC),自从索拉非尼获批在国家药监局药品审评中心抗肿瘤药物研发趋势分析城市上市后,肾癌申请量显着增加。因此,如何在当前激烈的竞争中制定合理的研发策略,找到合适的临床定位非常重要。2.4 () 细分肿瘤市场 过去十年,肿瘤学领域另一个突出的研究进展是生物标志物的测定和诊断试剂的开发和利用,使某些肿瘤领域得以分层患者筛查和个体化治疗模式已成为现实。
仅在 [4] 2011 年,FDA 批准的三种新药针对特定亚组:(;) 霍奇金病 CD30 表达;(;) 为 ALK 阳性;(; 和 -) 用于突变的黑色素瘤 [5]。此外,预计80%以上的肿瘤药物临床试验将伴随生物标志物的探索性研究。由于生物标志物的识别,医生可以依靠诊断技术为患者选择最有效的药物。它可能是发展最快的领域。根据其分子病理特征,已经明确确定了几个独立的亚组及其治疗方法:1)EGFR突变人群,TKI靶向EGFR靶点的首选包括吉布林治疗,如替尼和厄洛替尼;2) EGFR耐药突变(含),推荐EGFR/HER2双靶点TKI治疗,或c-Met联合第二代<@一、EGFR TKI治疗3)K-ras突变患者,推荐MAPK与AKT/PI3K抑制剂联合治疗;4)EML4-ALK阳性人群,推荐使用ALK抑制剂治疗。
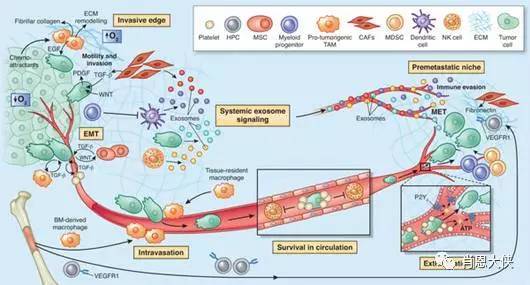
目前研究发现,除T790外,20%的EGFR耐药可能是由于C-met扩增。ROS1易位也可能是一种独立于EGFR、K-RAS、EML4-ALK基因的突变,未来可能会细分出新的突变。在人群亚群中,包括c-Met抑制剂和ROS1抑制剂在内的可能有效药物正在相应人群中进行研究[6]。也有研究表明,上述不同靶点联合给药,可以克服耐药性,带来比单一药物更好的疗效。基于生物标志物选择研究人群和治疗药物人群可能是未来的趋势,但对于开发者来说可能是一把双刃剑。一方面,生物标志物可以提高特异性,选择以利益为导向的人群进行临床试验,避免被无效人群稀释,提高有效性。临床试验的样本量也可以更小。但另一方面,无疑缩小了药物人群,增加了进入难度,多个靶点相同的药物争夺同一个小人群。对企业来说,即使药物成功上市,收益也可能低于预期,这不是企业想要的。而且,此类药物往往必须伴随诊断试剂的研发,相应的研发成本也需要考虑在内。3 讨论 分子靶向药物的研发充满活力和热情。一些已经成功上市的产品在临床治疗上也取得了一定的进步,但他们并不像预期的那样成功。截至目前,共有26种靶向药物获批上市,其中单克隆抗体11种,小分子化合物15种[7]。
然而,这些药物中很少有人像第一个小分子酪氨酸激酶抑制剂甲磺酸伊马替尼那样在治疗 CML 方面取得突破。2011年ASCO会议回顾了国家药监局药品审评中心8种不同抗癌药物发展趋势分析中9种生物制品近5年15项重点研究结果,获得的PFS和OS延长仅2-3个月,同时伴随着昂贵的治疗费用和一定的毒性[8]。一些研究人员开始质疑在肿瘤学领域进行如此大的投资是否值得?经分析,药物研发失败的原因有很多。要找到正确的靶点、正确的药物、正确的诊断试剂、敏感的肿瘤,所有这些都是不可或缺的。有时为正确的目标开发了错误的药物,有时为错误的目标开发了正确的药物。有时,临床试验的设计和研究人群的选择决定了成败。例如,对于b-raf,索拉非尼针头在黑色素瘤研究中并不成功,但由于对患者筛查的关键试验,证明了其有效性并获得了FDA的批准。同样对于 EGFR,吉非替尼在研究 (ISEL) 中没有证明生存获益,而厄洛替尼在 BR21 研究中取得了成功。在随后的吉非替尼研究中,选择了亚组分析中更有效的人群——腺癌和非吸烟者,结果取得了成功。有时针对错误的靶点开发了正确的药物。有时,临床试验的设计和研究人群的选择决定了成败。例如,对于b-raf,索拉非尼针头在黑色素瘤研究中并不成功,但由于对患者筛查的关键试验,证明了其有效性并获得了FDA的批准。同样对于 EGFR,吉非替尼在研究 (ISEL) 中没有证明生存获益,而厄洛替尼在 BR21 研究中取得了成功。在随后的吉非替尼研究中,选择了亚组分析中更有效的人群——腺癌和非吸烟者,结果取得了成功。有时针对错误的靶点开发了正确的药物。有时,临床试验的设计和研究人群的选择决定了成败。例如,对于b-raf,索拉非尼针头在黑色素瘤研究中并不成功,但由于对患者筛查的关键试验,证明了其有效性并获得了FDA的批准。同样对于 EGFR,吉非替尼在研究 (ISEL) 中没有证明生存获益,而厄洛替尼在 BR21 研究中取得了成功。在随后的吉非替尼研究中,选择了亚组分析中更有效的人群——腺癌和非吸烟者,结果取得了成功。索拉非尼针头在黑色素瘤研究中并不成功,但证明了其有效性,并因为患者筛查的关键试验获得了 FDA 的批准。同样对于 EGFR,吉非替尼在研究 (ISEL) 中没有证明生存获益,而厄洛替尼在 BR21 研究中取得了成功。在随后的吉非替尼研究中,选择了亚组分析中更有效的人群——腺癌和非吸烟者,结果取得了成功。索拉非尼针头在黑色素瘤研究中并不成功,但证明了其有效性,并因为患者筛查的关键试验获得了 FDA 的批准。同样对于 EGFR,吉非替尼在研究 (ISEL) 中没有证明生存获益,而厄洛替尼在 BR21 研究中取得了成功。在随后的吉非替尼研究中,选择了亚组分析中更有效的人群——腺癌和非吸烟者,结果取得了成功。
最终发现EGFR突变是影响疗效的关键预后因素,因为上述人群中EGFR突变率高导致了目前的结果。2011年最值得关注的产品(;),正是因为早期选择了ALK阳性产品进行临床试验,他们迅速取得了成功。这些成功案例无疑将对早期临床研究策略和靶向药物的设计产生重要影响。然而,目标的发现依赖于基础生物学知识的进步。迄今为止发现的细胞信号转导途径中有数百个靶点。毕竟,已经确定与临床疗效相关的生物标志物是有限的,并不是所有的药物都能有好运气。所以,第一个选择的具有特定的分子特征。在人群中进行临床试验尚不普遍,但在早期开始收集生物样本用于生物标志物的探索性研究似乎是一种更受欢迎的策略。转化医学和模型仿真技术的发展也提供了这种可能性。在基本生物复杂条件尚不清楚的情况下过早开发药物可能会阻止我们选择最有可能从治疗中受益的人群,从而导致研究失败。抗血管生成药物自1970年代理论提出以来,研究已久,等待已久,但成功的产品并不多。临床前观察到高活性,
对于相同治疗领域的相同靶点药物,有的成功了,有的失败了。例如,目前只有贝伐单抗在肺癌抗血管生成药物领域取得了成功。索拉非尼在肝癌和肾癌领域取得了成功,但在其他领域却频频传出坏消息,舒尼替尼和凡德他尼也是如此。这表明并非所有肿瘤血管都是相同的,不同肿瘤的肿瘤内皮细胞存在分子差异。也可能是因为没有发现有效的生物标志物,没有筛选出效益导向的人群,整体疗效结果被无效人群冲淡了。总之,靶向 VEGF 靶点的药物似乎还有很长的路要走。4 结语 在过去的十年里,抗癌药物成为创新药物研究最活跃的领域。各大药企纷纷进军肿瘤领域。国家药监局药品审评中心对抗肿瘤药物发展趋势的分析,让该领域的竞争一下子变得比以往更加激烈,面临的环境与十几年前。随着分子靶向药物研发的爆发式增长,至少有数百种药物正在开发中。可以想象,未来5-10年,市场将非常拥挤。如果算上目前国内外正在进行II/III期研究的抗肿瘤药物的数量,估计各个领域的现有库存至少需要20年才能用完。比预期更多的竞争可能会导致低于预期的市场份额。而且,由于临床试验的竞争,入群难度更大;由于需要证明生存获益,试验实施周期较长;由于新药不断上市,标准治疗方法发生变化,购买控制药物的成本更加昂贵,这会增加开发成本。利润率进一步降低。并且购买控制药物的成本更加昂贵,这会增加开发成本。利润率进一步降低。并且购买控制药物的成本更加昂贵,这会增加开发成本。利润率进一步降低。
新药价格太贵,医疗财政支出负担加重。政府可以干预医保报销,调整价格;行政部门可能会提高技术门槛,避免同类药品出现过多无差别重复申报,国家拨款也将减少。以上种种商业因素、临床因素、监管因素都可能导致肿瘤财富泡沫破灭。未来中国抗癌药物的研发和审批需要更多的冷静和理性。我们要充分评估我们所面临的环境和自身的实力,评估投入产出比,确定目标和定位。参考文献:1. 2000 和 2010;;;; .2.陈晓媛。2005-2010年我国化学药物和抗肿瘤药物申请和批准情况的系统回顾与分析[J]. 中国药学杂志, 2010, 45( 22): 1781 - 1785. 3. Jeff .Ten of. ,2011,sep:24-284. 文施.... ,2012,:6-115. Pham, The FDA Drug: What you need to know. 2012,62-71.6. West.A of Lung into .PLoS ONE,2012 ,7(2),,1-11.7... ,2010,9(6):427-428.8.玛丽Jo .ASCO比以往任何时候:是时候降温了吗?ASCO .2011.国家食品药品监督管理局药品审评中心抗肿瘤药物发展趋势分析2主要趋势分析:2.
国内外各大药企纷纷加大对抗肿瘤药物研发的投入。过去专注于抗肿瘤药物研发的公司不断加强,如罗氏。一些非肿瘤领域的公司也加入了行列,通过并购、合作等方式扩大肿瘤产品线。据统计,互联网上注册的临床试验中约有40%是抗肿瘤药物,2010年外国公司进入临床试验的化合物数量约为2005年的5倍[1]。SFDA对所有创新药的抗肿瘤创新药申请受理比例从2005年的10%左右上升到2010年的近40%。国产新药和进口新药的申请量均成倍增长[2]。国家重大新药创制项目申报的候选化合物中,近60%也是抗肿瘤药物。造成这一结果的可能原因,一方面是需求增加、人口老龄化、经济水平提高带来了人们对健康的高度关注,但仍有较高的各种肿瘤疾病的治疗需求未得到满足。尽管新药陆续上市,改善了临床情况,但并未发生明显变化。其次,由于肿瘤分子生物学研究的进展,新靶点的发现促进了新药的发现,其他领域发现的创新靶点相对较少。而且,由于耐药性问题,肿瘤往往容易复发,这就催生了新一代产品的开发。最后,更重要的原因是
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话