迫切需要肿瘤进展的关键介导因子-AS2在LUAD组织中上调
发布日期:2022-01-26 浏览次数:567
尽管表皮生长因子受体酪氨酸激酶抑制剂 (TKI) 已在肺腺癌 (LUAD) 患者中显示出疗效,但不可避免地会产生 TKI 耐药性,从而限制了长期结果。因此,迫切需要解决 LUAD 的耐药性问题。-AS2可能是各种类型肿瘤进展的关键介质。我们研究了-AS2 在改善肺腺癌中肿瘤恶化和奥希替尼耐药中的作用。在临床样本中,我们发现 LUAD 样本中的 -AS2 上调,预测较差的总体和无病生存率。-AS2沉默抑制LUAD细胞的增殖、迁移和肿瘤发生,以及奥希替尼在体外和体内对肿瘤细胞的治疗作用。-AS2海绵吸收miR-146b-5p,促进IL-6表达,激活IL-6/通路,并导致 LUAD 进展。miR-146b-5p 和 IL-6 水平与 LUAD 患者的预后相关。我们的研究结果表明,-AS2 通过靶向 miR-/IL-6/ 轴在腺癌细胞中发挥致癌因子的作用,并且可能是生存的预后指标。此外,它可能是提高奥希替尼对 LUAD 患者疗效的潜在治疗靶点。本文于2021年9月发表在“-”(IF:8.886)期刊。它可能是提高奥希替尼对 LUAD 患者疗效的潜在治疗靶点。本文于2021年9月发表在“-”(IF:8.886)期刊。它可能是提高奥希替尼对 LUAD 患者疗效的潜在治疗靶点。本文于2021年9月发表在“-”(IF:8.886)期刊。
技术路线
结果
1)-AS2 在 LUAD 组织中上调,与预后不良有关
为了研究 -AS2 在 LUAD 中的作用,我们使用 qRT-PCR 来检查 -AS2 在 56 个 LUAD 组织和匹配的正常瘤周组织中的相对表达。如图 1A 所示,-AS2 在 LUAD 组织中显着上调。为了验证-AS2 在 LUAD 中的表达,我们研究了 TCGA)-LUAD 数据库。与正常组织相比,-AS2 在肿瘤组织中的表达显着上调(图 1B)。- 与低表达患者相比,AS2 高表达患者的 DFS 和总生存 (OS) 率显着降低(图 1C 和 1D)。在 TCGA-LUAD 数据库中,低水平患者的 OS 显着高于 -AS2 水平高的患者(图 1E)。对接受EGFR-TKI治疗的晚期LUAD患者血液样本中-AS2表达的分析表明,-AS2低表达者对EGFR-TKI反应良好,而高表达者反应较差(图1F)。这些结果表明,-AS2 的表达显着升高与 LUAD 患者的不良预后和奥希替尼耐药相关。
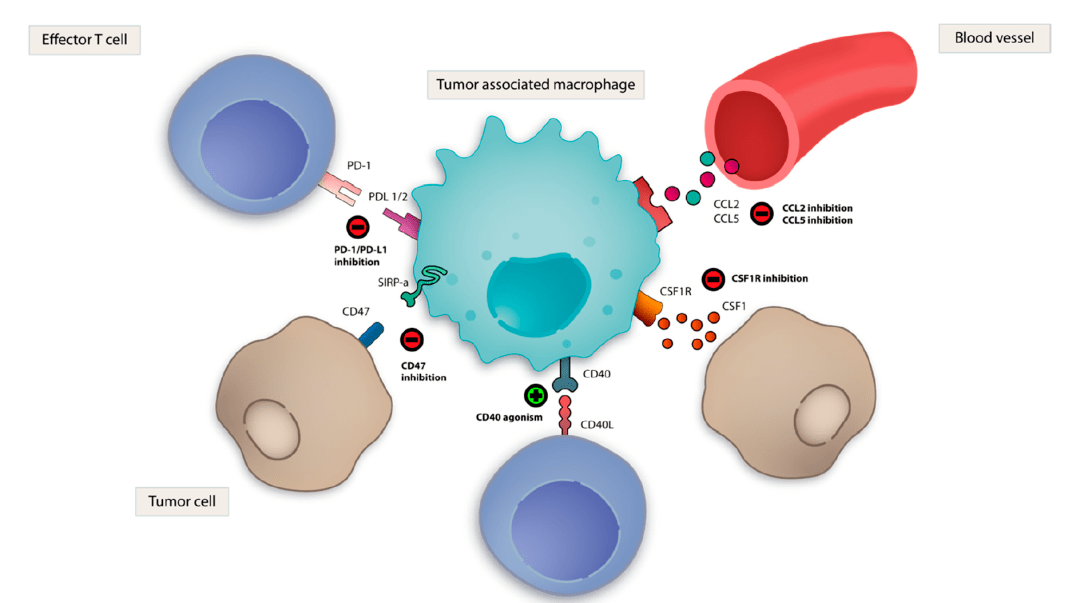
2)-AS2促进LUAD细胞增殖、迁移、侵袭和奥希替尼耐药
为了探索-AS2 在 LUAD 中的潜在生物学功能,我们将-AS2 靶向或对照转染到 PC9 细胞中。转染后48小时,通过qRT-PCR确认转染效率(图2A)。- AS2 的下调减少了 PC9 细胞增殖以及迁移和侵袭细胞的数量(图 2B-2D)。我们从亲本 PC9 和抑制浓度显着增加的细胞中获得了奥希替尼抗性 PC9/OR 和 /OR 细胞(图 2E)。- PC9/OR和/OR细胞中AS2的相对表达高于亲代细胞(图2F)。因此,我们确定了 -AS2 是否影响 LAUD 细胞对奥希替尼的敏感性。如图 2G 所示,与对照细胞相比,-AS2 缺陷型 PC9/OR 和/OR 细胞中奥希替尼的 IC50 显着降低。
我们通过在 PC9 和细胞中过表达 -AS2 进一步研究了 -AS2 的功能。我们建立了稳定过表达-AS2的细胞(图2H)。与对照组相比,-AS2的过表达促进了细胞的增殖、迁移和侵袭能力(图2I-2K)。此外,我们还检测了-AS2 上调对LAUD 细胞对奥希替尼敏感性的影响。如图 2L 所示,-AS2 表达的上调导致 PC9 和细胞中奥希替尼的 IC50 增加。Cue-AS2 促进 LUAD 细胞增殖、转移和对奥希替尼的耐药性。
3)-AS2 在 LAUD 中充当 miR-/IL-6 的海绵
我们进行了 RNA-seq 以探索 -AS2 在 -AS2 敲低 PC9/OR 细胞中的潜在靶标结合和 mRNA。有209个上调基因和414个下调基因(图3A)。当-AS2被抑制时,包括细胞因子-细胞因子受体相互作用、IL-17信号传导和耐药性在内的信号通路发生改变(图3B)。在潜在候选者中,miR-146b-3p、miR-146b-5p、miR-615-3p、miR-99b-5p、miR-1307-5p和miR-378d的表达水平与-AS2呈负相关。qRT-PCR分析证实-AS2上调后-3p、-5p和-5p的表达明显下调。相反,-AS2 的沉默增强了 -3p、-5p 和 -5p 的表达(图 3C 和 3D)。
4)-AS2 通过与 miR-146b-5p 竞争促进 LAUD 的恶性特性和奥希替尼耐药性
生物信息学分析揭示了-AS2 和-5p 之间的假定互补序列。为了确定它是否确实被-5p、野生型(-wt)和-5p结合位点靶向,我们合成了突变体-AS2(-AS2-mut)荧光素酶报告基因(图4A)。结果表明,-AS2-WT 与 -5p 模拟物的共转染显着降低了 PC9 细胞中的荧光素酶活性(图 4B)。此外,我们进行的 RIP 实验表明 -AS2 和 -5p 在 LUAD 细胞中优先富集含 AGO2 的珠子,从而验证 -AS2 和 miR-146b-5p 之间的相互作用(图 4C)。为了验证-5p 在-AS2 调节 LUAD 进展中的作用,我们进行了救援实验。用-5p 模拟物处理阻断了-AS2 过表达诱导的PC9 细胞中的细胞增殖和迁移(图4D-4F)。相比之下,抗 miR-146b-5p 治疗减弱了 -AS2 下调对 PC9/OR 细胞增殖和迁移的抑制作用(图 4G-4I)。此外,在具有-AS2 上调的PC9 细胞中,奥希替尼增加的IC50 被-5p 模拟物部分逆转(图4J)。为了研究 LUAD 中 miR-146b-5p 的临床相关性,我们使用 qRT-PCR 在 127 个原发性 LUAD 组织中检测了 miR-146b-5p 的表达。- AS2 与 miR-146b-5p 表达呈负相关(图 4K)。miR-146b-5p 高表达的患者比低表达的患者预后更好(图 4L 和 4M)。这些结果表明-AS2通过海绵吸附-5p的作用,可以部分克服-AS2对LUAD细胞增殖、迁移和奥希替尼敏感性的促进作用。
5)-AS2 通过干扰 miR-146b-5p/IL-6/ 轴促进 LAUD 的恶性特性和奥希替尼耐药性
生物信息学分析预测 IL-6 是 -AS2/miR-146b-5p 轴的靶基因。使用生物信息学工具鉴定了 miR-146b-5p 和 IL-6 的 3'UTR 区域之间的潜在结合位点(图 5A)。荧光素酶报告基因检测显示,IL-6-WT 载体的荧光素酶活性低于 IL-6-Mut 载体(图 5B)。为了阐明-AS2和IL-6之间的关系,我们使用qRT-PCR检测过表达或敲低-AS2的LAUD细胞中IL-6的表达。结果表明-AS2的上调增强了PC9细胞中IL-6的表达(图5C),而-AS2的沉默抑制了PC9/OR细胞中IL-6的表达(图5D),这也通过(图5C)验证。图 5E)。我们推测 -AS2 可能通过与 -5p 相互作用来激活 IL-6/通路。下一个,我们探索了-AS2和通路之间的关联。证实过表达-AS2的PC9细胞中p-蛋白水平增加,而-AS2敲低的PC9/OR细胞中p-蛋白水平降低。值得注意的是,水平保持不变(图 5E)。此外,在 PC9 细胞中,-AS2 过表达对 IL-6 的诱导和 p 上调被 miR-146b-5p 模拟物阻断(图 5F)。一致地,-AS2 下调 IL-6 和 IL-6 的表达,这在 PC9/OR 细胞中被 -5p 抑制剂基本消除(图 5G)。在 -AS2 过表达的 PC9 细胞中,通过下调 IL-6 或隐丹参酮的表达,部分逆转了奥希替尼增加的 IC50(图 5H 和 5I)。接下来,我们分析了LUAD样本中-AS2、IL-6和-5p的表达,-AS2 与 IL-6 呈正相关,IL-6 与 -5p 呈负相关(图 5J)。此外,高 IL-6 表达表明 LUAD 患者的 DFS 和 OS 较低(图 5K 和 5M)。总之,-AS2 可能通过与-5p 结合来激活 IL-6/通路,从而促进 LUAD 的恶性特征。
6)-AS2 在体内抑制肿瘤生长和奥希替尼耐药
为了探索-AS2 在体内肿瘤发生中的作用,我们进行了异种移植肿瘤实验。与对照相比,上调的 AS2 显着增加了肿瘤体积和重量。相反,沉默-AS2 减少了肿瘤体积和重量(图 6A-6C)。与对照组相比,植入小鼠的PC9--AS2细胞获得的肿瘤组织中-AS2的表达上调。相反,在接种PC9/OR--AS2细胞的小鼠的肿瘤组织中,-AS2的表达降低(图6D)。与对照组相比,接种PC9--AS2细胞的小鼠肿瘤组织中miR-146b-5p的表达水平降低。相反,在接种PC9/OR--AS2细胞的小鼠的肿瘤组织中,miR-146b-5p的表达增加(图6E)。接下来,我们使用 IHC 方法分析 Ki-67、 的表达 肿瘤组织中的 IL-6 和 p-。与PC9-小鼠相比,PC9--AS2小鼠肿瘤中Ki-67、IL-6和p-的表达明显增强。相反,与PC9/OR--AS2小鼠相比,PC9/OR-小鼠的肿瘤中Ki-67、IL-6和p-的表达降低(图6F)。接下来,为了研究靶向-AS2对体内奥希替尼耐药LUAD细胞肿瘤生长的影响,我们设计并使用ASO靶向-AS2作为拮抗剂来抑制内源性-AS2的表达。与奥希替尼联合NC组相比,奥希替尼联合ASO治疗明显抑制肿瘤生长,肿瘤生长抑制率为72.4%(图6G和6H)。与 NC 组相比,奥希替尼 + ASO 联合治疗也显着降低了肿瘤重量(图 6I)。全面的,
结论:-AS2通过海绵化miR-146b-5p上调IL-6的表达,激活信号通路,在体内诱导奥希替尼耐药和肿瘤生长。因此,我们的结果提供了实验证据,表明-AS2 是 LUAD 的潜在治疗靶点。
参考:
Si J, Ma Y, Lv C, Hong Y, Tan H, Yang Y. -AS2 在肺中的 miR-146b-5p/IL-6/ 轴。摩尔特。2021 年 9 月 14 日;26:613-624. doi: 10.1016/j.omtn.2021.09.003. PMID: ; : .


