【天学网:双语阅读】转移性非小细胞肺癌的立体定向
发布日期:2022-03-24 浏览次数:266
转移性非小细胞肺癌的立体定向放射治疗:肝转移的免疫治疗和放射治疗
- 概括-
一旦出现肝转移,患者的生存率就会降低,大多数治疗都没有反应。这可能是由于肝脏的微环境导致肿瘤从免疫系统中逃逸。
立体定向放射治疗有助于提高免疫系统的敏感性,提高免疫治疗的效果。将免疫检查点抑制剂与放射疗法相结合以改善对免疫疗法的反应将会很有趣。
然而,放射治疗诱导抗肿瘤T细胞的机制仍不清楚。
临床前研究发现,放疗可增强抗肿瘤免疫反应,增加肿瘤抗原释放,并诱导 T 细胞浸润。放射疗法目前正在研究其增强对免疫疗法反应的能力。
然而,剂量分割和放疗时机的最佳组合尚不清楚。
本文旨在探讨立体定向放射治疗在转移性非小细胞肺癌,尤其是肝转移患者中的作用,以及免疫治疗与放疗联合可能的免疫学意义。
的 with 和 to any 。这可能是由于 to from 。身体可能对 . 是 - 与 to to 。, 经反 T- 。
, , 和 T 细胞。是为了它。, 如何剂量- 和 是 。这样做的目的是为了在非细胞肺中发挥 Body 的作用,on with 和 the and 。
-介绍-
肺癌是全球癌症相关死亡的主要原因。非小细胞肺癌()约占肺癌病例的 85%,约 75% 的病例被诊断为晚期,1 年生存率为 15-19%。
尽管免疫检查点抑制最初取得了令人鼓舞的结果,但这种方法将转化为“慢性疾病”的希望仍然难以捉摸。事实上,虽然免疫检查点抑制对一些患者有明显的好处,但大多数患者没有反应和/或随后产生耐药性。特别是,即使在接受治疗的患者中,肝转移也与较差的生存率密切相关。在这些情况下,肝转移仍然是最令人担忧的疾病之一。
当今癌症治疗的一项主要工作是更好地了解肿瘤如何逃避免疫系统。在此背景下,放射治疗在克服免疫抑制性肿瘤微环境(TME)方面发挥了积极作用。近年来立体定向全身放射治疗 (SBRT) 的使用增加,改善了放射治疗的整体范围,并显着改善了某些患者的预后,例如转移灶数量有限的患者。
太平洋试验的结果引起了人们对结合放射疗法和免疫疗法以优化免疫检查点抑制的临床意义的兴趣。后者涉及 IIIA/B 期非小细胞肺癌(TNM VII 版)患者,在放疗和化疗联合治疗所有严重疾病(包括原发性肿瘤和转移性淋巴结疾病)时接受纳武单抗治疗,无进展(PFS)和总生存期。操作系统)都得到了改善。
本综述旨在阐明 SBRT 在转移患者,尤其是肝转移患者中的作用,以及放疗和免疫治疗联合可能产生的免疫学影响。
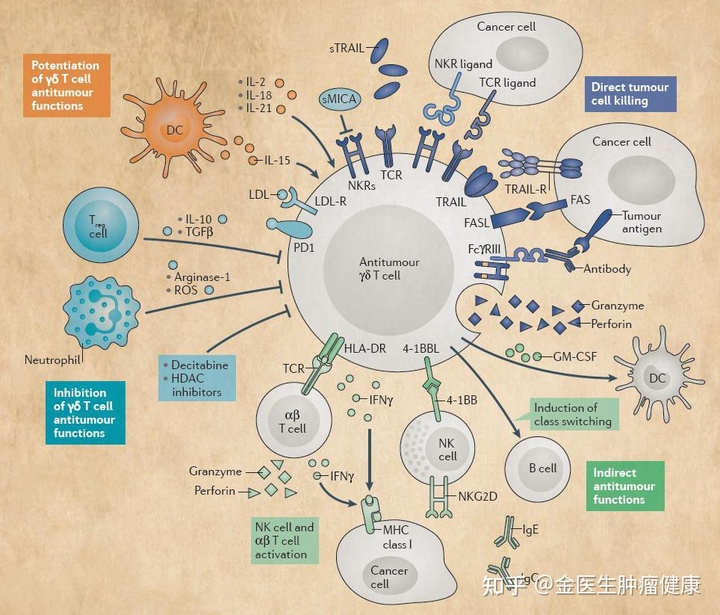
— 放疗与免疫疗法的结合:一把双刃剑 —
对癌细胞的免疫反应由所谓的三个“E”(消除、平衡和逃避)关键字介导。首先,免疫系统能够清除癌细胞。其次,免疫系统和逃避初始免疫作用的肿瘤细胞之间存在平衡。最后,免疫系统的逃逸使癌细胞在免疫抑制的 TME 中增殖。
传统上,放射治疗的成败由经典放射生物学众所周知的四个“R”来介导:再分布()、再氧合、修复和再填充。在免疫肿瘤学领域,将“肿瘤排斥”定义为放射生物学的第五个“R”,即局部放射治疗将肿瘤细胞原位转化为抗癌疫苗。这些关于免疫系统排斥肿瘤病变的新发现开辟了放射生物学的新领域。
SBRT与免疫检查点联合抑制的生物学基础
放射治疗与免疫系统的相互作用可以用多种方式解释。
首先,辐射诱导的肿瘤表面组织相容性复合物 I 类 (mhci) 蛋白表达增加可能导致细胞毒性 T 细胞识别肿瘤相关抗原 (TAA)。
其次,受辐照的细胞可以吸引巨噬细胞通过细胞表面释放与风险相关的分子模式(免疫原性分子)。钙网蛋白从内质网转移到细胞表面,充当树突状细胞和巨噬细胞的吞噬信号,增强免疫原性细胞死亡。
即使 TAA 充分共享(尽管它们在不同解剖病变或同一大块病变中分布不均匀),由于局部免疫抑制,CD8+ T 细胞可能能够进入所有部位的病变。放射治疗可以改变瘤床的血管内皮细胞并释放特定的趋化因子,从而促进活化的免疫细胞募集和进入肿瘤。事实上,已经报道了由辐射损伤获得的 TME 中的 CD8+ T 细胞侵袭引起的局部抗肿瘤免疫反应。放射治疗增加了内皮细胞中 E-选择素和细胞间粘附分子 (ICAM-1)) 的表达,改变了肿瘤血管化,并使 T 细胞浸润更加稳健。肿瘤血管内皮的通透性增加是必要的,但不足以穿透。在此背景下,趋化因子(如和 10),通过辐射诱导的干扰素-γ 信号传导,参与促进 CD4+e-CD8+ T 细胞的募集发挥了战略作用。此外,放射治疗促进了促炎细胞因子 (TFN-alfa-ifn) 的释放,对浸润的免疫细胞产生抗肿瘤作用。
考虑到 TME 随病灶位置而变化,RT 可能会根据目标病灶的位置而产生不同的效果。具体而言,肝脏的特点是高度免疫抑制 TME,部分由耐受性树突状细胞、巨噬细胞和肝窦内皮细胞介导,因此肝转移灶的照射可能特别有益。
另一方面,尽管有所有这些免疫原性特性,放射治疗可能具有一些免疫抑制作用。辐射的主要后果之一是淋巴细胞耗竭,并且已知治疗引起的淋巴细胞减少与不良的临床结果有关。淋巴细胞对细胞毒性辐射敏感,尤其是常规辐射。
辐射还增加了 TME 中的抗炎细胞因子转化生长因子 β (TGFβ),从而抑制了肿瘤内的免疫反应。事实上,M2 巨噬细胞激活辐射诱导凋亡癌细胞分泌多种抗炎细胞因子,包括 TGF-β。
肿瘤组织学和不同免疫疗法的应用可能会影响剂量分层和时机的生物学复杂性。SBRT 允许在几个部分中提供大剂量的辐射,从而产生高生物有效剂量 (BED)。
SBRT实际上被认为是治疗肺部和肝脏肿瘤的一种方法,其特点是病变小且数量有限。
专门针对肝细胞癌,据报道 SBRT 在 1、2 和 3 年以及在 1、2 和分别为 3 年 3 年时的存活率分别为 32%-100%、55%-100% 和 21%-82%。即使几乎没有证据,最近的报告也表明 SBRT 似乎与经动脉化疗栓塞或射频消融一样有效。至于肺癌,关于SBRT后局部控制率的数据很少。
SBRT/大分割剂量已被证明比传统放射疗法 (cRT) 更具免疫原性,尽管迄今为止发表的研究已经比较了不同床位的方案,并且尚未就最佳剂量选择得出确切的结论。
生物标志物和患者选择
有几项工作旨在识别预测对免疫检查点抑制剂反应的生物标志物。PD-L1 的表达与对免疫治疗的强烈反应相关,并被广泛用作临床实践中更好的预测标志物。然而,一些没有 PD-L1 表达的患者对这些治疗有反应,也可能是由于与 IHC 检测相关的问题。总之,为了选择患者并实施正确的治疗,还需要考虑其他肿瘤特征。发现中度至高度肿瘤突变负荷代表了纳武利尤单抗治疗的益处。在 TME 的因素中,TILs 浸润的肿瘤对免疫治疗更敏感。
这一挑战的目标必须是选择可以从消融性 SBRT 联合全身治疗中获益的肝损伤患者。从这个角度可以推测,肿瘤疾病负担较少的患者,例如较少的代谢抑制剂,可能会受益于长期的局部控制。最近公布的数据似乎证实了这一趋势。
—非小细胞肺癌联合放射免疫的临床证据—
本文主要从四个方面探讨免疫检查点抑制与放疗的时机和联合应用:放疗后免疫检查点抑制巩固疾病反应、免疫检查点抑制联合放疗、免疫检查点抑制后放疗在转移性疾病中的应用。寡转移情况下的放射治疗和免疫检查点抑制。
放射治疗前的免疫检查点抑制
太平洋试验是一项双盲随机研究,其中局部晚期非小细胞肺癌患者随机接受纳武利尤单抗或安慰剂联合化疗(2:1)。入组的 709 名患者中,473 名接受了 mAb和 236 人接受安慰剂。中位随访时间为 25.2 个月(范围 0.2-43.1)。获得了 mAb 改善 PFS 的统计证据。事实上,积极治疗组和安慰剂组的平均 PFS 分别为 16.8 个月和 5.6 个月(当时的增益为 11.6 个月)。太平洋试验的亚组分析表明,无论是在随机分组后 14 天之前还是之后接受放化疗,接受 mAbs 的患者的 PFS 均有所改善。
重要的是,当在放射治疗前使用 PD-L1 表达并抑制免疫检查点时
基于 在放化疗后的安全性数据,Lin 等人假设在放化疗中同时添加 mAb 可以提高生存率,而不会产生额外的毒性。为了检验这一假设,设计了一项 II 期试验。该试验分为两部分,同步放化疗加 mAb,第 1 部分(入组 10 名患者)和同步放化疗加免疫治疗,第 2 部分(入组 30 名患者)。主要终点是安全性和毒性。最近在 2019 年 ASCO 年会上公布的初步调查结果显示,没有证据表明试验的第 1 部分和第 2 部分之间的安全性存在差异。特别是在第 1 部分观察到 3 级肺部感染(1/10 pts),在第 2 部分观察到 3 级放射性肺炎(1/30).
此外,鉴于有关免疫检查点抑制剂作为放射增敏剂作用的新数据,一些试验正在探索局部非小细胞肺癌的放疗-免疫检查点抑制化疗-保留方案。
放射治疗的序贯给药和免疫检查点抑制的数据也可用于转移性疾病。-001 的二次分析显示 PFS(中位 PFS 为 4.4 个月 vs. 2.1 个月)和 OS(中位 PFS 为 4.4 个月 vs. 2.1 个月) 在免疫治疗前接受 RT 的转移性或患者的 OS 为 10.7 个月 vs.5.3 个月) 比未接受 RT 的患者。在多变量分析中,任何先前的放射治疗是与改善 PFS 或 OS 相关的唯一独立因素。
另一方面,其他研究表明,放射治疗可能会对接受免疫抑制治疗的转移性患者的预后产生负面影响。例如,虽然在 024 试验中一线 提高了非小细胞肺癌的反应率和生存率,PD-L1 表达 >50%,但在一项类似的研究中比较了一线化疗和铂类化疗 (026),这些结果没有得到证实。
因此,基于这些结果,可以推测放疗可能会影响TME,在这种情况下,抑制了照射区域的免疫检查点抑制。
根治性放疗往往是大型转移瘤试验的排除标准,因此对于放疗联合免疫检查点抑制的疗效方向仍缺乏有力证据。唯一允许进行放射治疗的试验是:017[60] 和 057(在预处理中使用多西他赛进行测试),允许在治疗开始前 2 周内进行放射治疗。227 132/150 在 6 个月内无剂量限制给药,010/189 试验在 6 个月内以 >30gy 的剂量给药。相比之下,姑息性放疗通常是允许的(OAK 试验,010/189 试验),即使在某些试验中存在一些限制(017/057 试验、189 试验和 150 试验)。
联合放射治疗和免疫治疗的毒性证据也很弱。然而,据报道,在免疫检查点抑制后发生肺炎的患者中有 63%(4%)未接受胸部放射治疗。在试验中,与之前的放疗相比,3 级肺部不良事件没有差异。这表明在转移性环境中序贯放射治疗和免疫检查点抑制具有良好的安全性。
在 -RT 研究中,76 名 IV 期非小细胞肺癌患者入组,其中 64 人接受了至少一个周期的 -,计划每 21 天服用 200 毫克。该研究计划随机分配患者接受(主动臂)或不接受(控制臂)SBRT(8gy x 3 臂,在派姆单抗前 7 天)进行单一转移定位。主动组和对照组的平均 PFS 分别为 6.6 个月和 1.9 个月。
LAT 研究包括 51 名寡转移患者(定义为最多 4 个部位)。患者首先接受局部消融治疗 (LAT),然后每 21 天接受一次派姆单抗 200 mg(固定剂量),持续 4-12 周,直至疾病进展 (PD) 或中毒。LAT 包括手术(30 分)、SBRT(30 分)和放化疗(23 分)。主要终点是 PFS(由(实体瘤反应评估标准)1.1 计算)和来自 LAT 的 OS。转移部位分布如下:肺16个,脑18个,肝9个,骨9个。平均 PFS 为 25 个月。6 个月、12 个月和 18 个月后的死亡率分别为 0、8% 和 21%(需要强调的是,在诊断为 III-IV 期的患者中,预计 1 年死亡率为为 81%。介于 % 和 85% 之间。两种 G3 肺炎,2 例 G3 结肠炎,1 例 G3 肾上腺衰竭,未观察到 G4-5 事件,治疗耐受性良好。未达到中位 OS。
用放射疗法直接打击免疫原性较差的部位可改善免疫治疗反应:以肝脏为例
根据最近的研究,肝转移患者预后较差,平均 OS 仅为 3 个月,对标准化疗的反应有限。发表在 ASCO 2018 上的研究发现,肝局部转移患者的 OS 比肾上腺转移患者短。
考虑到TME因疾病部位而异,推测肝脏的免疫抑制微环境(具有免疫抑制作用的巨噬细胞和耐受性树突状细胞)可能有助于免疫治疗期间肿瘤逃避抗肿瘤免疫监视。
另一方面,对 017/057 试验的亚组分析显示,在 193 名基线肝转移患者中,其导致的 OS 比标准多西紫杉醇更长(HR 0.68;95% CI,0.@ >50-0.91). 同样,在 2019 年 ASCO 上提出的 III 期试验的亚组分析[64] 在单克隆抗体中添加阿特唑林可显着改善 PFOS 和 PFOS。肝转移,化疗全疗程,贝伐单抗和阿特珠单抗达到 8.2 个月(HR 0.41)。有趣的是,阿特珠单抗加铂化疗 vs 贝伐单抗加铂化疗(5. 4 个月),这表明只有免疫疗法和抗血管生成药物的组合才能提高生存率。
据推测,肝脏可能具有抵消血管生成反应的微环境。事实上,在等人的研究的亚组分析中。与其他转移部位相比,肝转移患者从贝伐单抗中获益更多(HR 0.68, 95%CI 0.49-0.96)。肝肿瘤血管化(正弦内皮细胞)可能与抗血管生成敏感性有关。这导致假设放射治疗也可能发现肝转移的适应症。
尽管肝脏是一个免疫原性较差的部位,但在 SBRT 后可以看到肝脏微环境的一些变化。事实上,肝脏辐射可能会增加早期全身免疫激活,尽管临床效果取决于身体维持这种全身激活的能力。
由此产生的血液免疫标志物的短暂改善表明肝脏放疗增加了外周血 T 细胞活化,这可能对患者有临床益处。相关标志物与表达 4-1BB 和 PD1 的 CD8+ 细胞比例增加有关。此外,如许多基础科学报告和临床前分析中所述,确定 CD8+ T 细胞是辐射诱导的全身反应的主要介质,并且需要更高的消融剂量(12-30 Gy)来获得这些免疫系统效应激活.
因此,最终,肝放疗后的临床益处可能取决于克服具有抑制功能的标志物的代偿性增加。由于缺乏关于肝脏放疗的数据,因此无法推测肝脏对放疗更敏感的机制。此外,没有关于肝脏照射后潜伏期影响的数据。
—挑战与展望—
我们需要进一步的证据来提高局灶性放疗的疗效,确定正确的治疗顺序,使用最好的免疫原性药物,以及选择正确的放疗分次。事实上,尽管目前的数据令人鼓舞,但仍有几点需要仔细探索。
一是如何提高对免疫原性部位局部放疗的控制,找到正确的免疫治疗组合。Paz Ares 等人展示了使用第一类双功能免疫检查点抑制的正在进行的试验的初步结果。在 2018 年 ASCO 年会上。已经证明放疗后TGFb增加,因此放疗后可以有效地测试类似的药物(例如在太平洋地区进行的试验以避免局部这种负面影响)。
第二点是选择放射治疗的类型,以减少与放射治疗相关的缺氧。对于使用高 LET(线性能量转移)辐射来降低辐射阻力的 X 射线,描述了根据氧浓度增加辐射灵敏度的策略。光子cRT的缺点在于其免疫抑制机制,质子的应用不仅可以增强放疗的免疫辅助作用,还可以减少这种负面作用。临床前研究支持这一假设,体内研究正在进行中。Wang 等人描述了放射治疗联合免疫治疗的最佳剂量和分割的一些临床前数据。. 放射和免疫疗法普遍缺乏,尽管有大量关于免疫治疗反应标志物(单一疗法或联合抗 PD-L1 和抗 CTLA-4),例如 PD-L1 或肿瘤突变负荷)反应的生物标志物的数据。王被个体化选择合适的分级。取决于辐射剂量的 DNA 外切核酸酶的表达。信号的激活或消除取决于辐射剂量和分次,并且可能与没有反应者转化为免疫治疗反应者有关。高剂量的单一成分(12-18gy)诱导表达水平足以降解 DNA。受辐照细胞细胞质中的 DNA 消除了干扰素-I 通路及其下游的激活。相比之下,传统的分级分离方法,重复剂量低于诱导剂量阈值,可以产生干扰素 B. 依赖性树突状细胞 (DC),其激活原发性肿瘤特异性 CD8 T 细胞并且是检查点抑制的存在介导了辐射和未辐射肿瘤完全消退的惊人效果。然而,由于测试的剂量范围广,并且与文献不一致,因此在定性选择剂量时必须考虑肿瘤异质性。
另一个问题是转移性疾病的放疗和免疫治疗的最佳时机仍不清楚。而-001关于这个问题的数据还没有公布。免疫治疗前放疗可上调肿瘤PD-L1表达,并通过免疫治疗阻断PD-1/PD-L1轴。然而,同时进行放疗和免疫治疗可能会加剧这种协同作用,从而抑制免疫治疗的效果。这种可能性正在正在进行的 1 期试验中得到验证。根据来自 189 的数据,肝脏 SBRT 在增强化疗加免疫治疗效果方面的免疫原性作用可以保留到进展较慢的环境中。另一方面,正在进行的试验(如 )正在测试局部化疗、免疫治疗和放射治疗的安全性和有效性。然而,初步数据表明联合治疗似乎是安全的。因此,在联合化疗和免疫治疗期间肝转移发生进展的患者中,添加 SBRT 可能是安全有效的(附表 189)。同样,在肝转移灶中加入 SBR 可加重 SBR 的血管生成作用,协同全身治疗的效果。
最后,没有关于肝转移 SBRT 后副作用的数据。尽管肝脏病变的放射治疗在局部控制、安全性和 OS 方面取得了令人鼓舞的结果,但其有效性取决于肿瘤大小、处方剂量和组织学。
患者特异性独特型疫苗可能是提高放射治疗局部疗效的新挑战。在肿瘤学中,疫苗可以诱导针对癌症的免疫反应以预防 PD。有两大类疫苗:(一)肿瘤相关抗原疫苗(含有激活免疫系统的肿瘤特异性抗原)和(二)树突细胞疫苗(促进树突细胞抗原呈递)。据报道,可以使用低剂量放射疗法而不是化学疗法来刺激全身免疫的假设,并得到数据的支持,表明被辐射杀死的细胞更具“免疫原性”。CpG 疫苗用于多种癌症,目的是刺激先天免疫系统。它被假设为 CpG 与其他疗法的协同作用。这一假设似乎从对淋巴瘤患者的研究中得到证实,后者的模型包含所有相关的肿瘤抗原,并且相对无毒。这方面的初步结果由 等人发表。世卫组织报告说,使用 CpG 似乎是一种检测临床明显肿瘤的创新方法。
因此,综上所述,在非小细胞肺癌()肝转移患者中,当免疫治疗无法单独控制 PD 时,可以考虑将放射治疗作为免疫治疗的一种形式。尽管从机制的角度来看,放射治疗和免疫治疗是一把双刃剑,但从更实用的角度来看,这种治疗策略得到了临床实践中最新证据的支持。在不久的将来,真正的挑战是从个体化医疗的角度研究和开发能够指导我们将免疫治疗和放射治疗相结合的生物标志物。
【本站为非营利性学术交流平台,部分信息来源于网络。如涉及版权问题,请及时与管理员联系;所有文章仅供公益交流,不代表本站立场。欢迎提供资料、资料等,投稿邮箱: ,稿件一经录用,一律有偿。】


